Désinfectant pour les mains : comment l’enregister auprès de la FDA?

Désinfectant pour les mains – approbation finale de la FDA
Après avoir examiné l’innocuité et l’efficacité des désinfectants pour les mains, la Food and Drug Administration des États-Unis a décidé que des dizaines d’ingrédients actifs ne pouvaient pas être utilisés dans les désinfectants antiseptiques, mais l’agence veut toujours des réponses sur l’ingrédient actif le plus courant. Les 28 ingrédients actifs présentés dans la plupart des produits antiseptiques ne se sont pas qualifiés pour son OTC Examen des médicaments. Il s’agit notamment du chlorure de benzéthonium et du triclosan, tous deux utilisés pour prévenir les infections bactériennes.
Les fabricants utilisant ces ingrédients doivent obtenir l’approbation de la FDA, NDA ou ANDA pour continuer à commercialiser ces ingrédients.
Dans cette règle finale, les lavages antiseptiques, les antiseptiques médicaux, les antiseptiques de premiers soins ou les antiseptiques utilisés par l’industrie alimentaire sont exclus.
Ingrédients actifs utilisés dans les produits antiseptiques
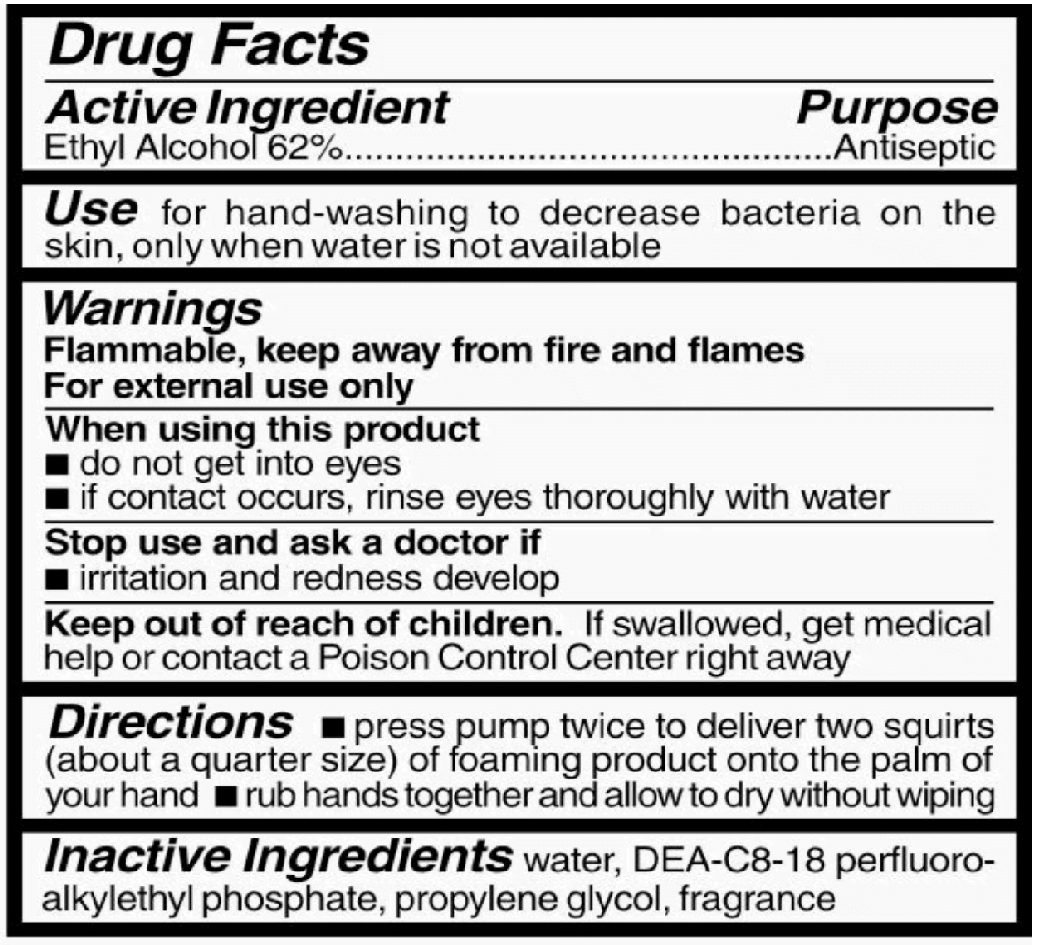
– L’alcool éthylique (éthanol) est un ingrédient commun utilisé dans les produits de beauté et cosmétiques, ses propriétés antimicrobiennes en font également un choix idéal pour tuer les virus, les bactéries et les champignons.
– L’alcool isopropylique est également un ingrédient antiseptique dans les désinfectants pour les mains. Il est utilisé comme astringent dans la plupart des tonifiants pour la peau et des formules raffermissantes.
– Le chlorure de benzalkonium est ajouté aux frottements antiseptiques non seulement pour tuer les germes lors de l’application mais également pour inhiber leur croissance future.
Procédure d’enregistrement auprès FDA et obtenir le numéro NDC pour le désinfectant pour les mains
a.Enregistrement de l’établissement 5 jours ouvrables (tout établissement engagé dans la fabrication, le reconditionnement, le réétiquetage ou la récupération d’un produit médicamenteux pour la distribution commerciale est tenu de s’inscrire auprès de la FDA).
b. Création unique de compte US FDA “Labeler code” 2 semaines; La FDA contrôle la vitesse à laquelle cela sera terminé. (Un étiqueteur est une entreprise qui fabrique (y compris les réemballeurs ou les réétiqueteurs) ou distribue (sous son propre nom) le médicament.)
c.Notification électronique de la FDA = 3 à 5 jours ouvrables jusqu’ à 5 produits, après que la FDA a attribué l labeler code
Remarque: ce n’est qu’après la notification électronique que le produit peut être importé aux États-Unis.
Ingrédients inadmissibles
Benzethonium chloride
Chloroxylenol
Chlorhexidine gluconate
Cloflucarban
Fluorosalan
Hexachlorophene
Hexylresorcinol
Iodine complex (ammonium ether sulfate and polyoxyethylene sorbitan monolaurate)
Iodine complex (phosphate ester of alkylaryloxy polyethylene glycol)
Methylbenzethonium chloride
Nonylphenoxypoly (ethyleneoxy) ethanoliodine
Phenol (equal to or less than 1.5 percent or greater than 1.5 percent)
Poloxamer iodine complex
Povidone-iodine 5 to 10 percent
Secondary amyltricresols
Sodium oxychlorosene
Tribromsalan
Triclocarban
Triclosan
Triple dye
Undecoylium chloride iodine complex
Polyhexamethylene biguanide
Benzalkonium cetyl phosphate
Cetylpyridinium chloride
Salicylic acid
Sodium hypochlorite
Tea tree oil
Combination of potassium vegetable oil solution, phosphate sequestering agent, and Triethanolamine
Si vous avez l’intention de vendre un désinfectant pour les mains aux États-Unis et n’êtes pas sûr de la procédure et des réglementations, veuillez contacter notre consultant en réglementation FDA ou appelez-nous +1 727 3509380 pour les États-Unis

Pasquale Carvelli is a Regulatory Strategy & International Compliance Advisor for Cosmereg, an international regulatory affairs company supporting manufacturers, distributors, and brand owners navigating complex compliance frameworks across multiple jurisdictions.
Through a multidisciplinary network of certified safety assessors and regulatory experts, he oversees strategic compliance pathways for cosmetic, food, and supplement products entering regulated markets.


