Accompagnement à l’enregistrement et à l’approbation FDA des dispositifs médicaux
Le terme « dispositif médical » désigne une large gamme de produits, allant des équipements de protection pour les professionnels de santé aux logiciels médicaux, en passant par les instruments chirurgicaux, et bien d’autres encore.
Aux États-Unis, les dispositifs médicaux sont réglementés par la Food and Drug Administration (FDA). Selon leur classification et leur niveau de risque, certains dispositifs doivent obligatoirement obtenir une approbation ou une autorisation préalable de la FDA avant d’être commercialisés sur le marché américain.
- Service professionel
- Soumission FDA simplifiée
- 10+ ans d’expérience
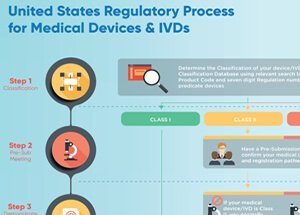
Réglementation de la FDA sur les dispositifs médicaux aux États-Unis
Enregistrement d'établissement médical et liste de matériel
Les fabricants d’instruments médicaux de toute classe doivent s’inscrire auprès de la FDA. Les fabricants étrangers doivent également désigner un agent américain qui agira en tant qu’intermédiaire entre le fabricant et la FDA. Cosmereg peut aider votre entreprise à enregistrer des établissements. Nous proposons également un service complet aux agents américains pour nos clients étrangers.

Notification avant la vente 510 (k)
De nombreux dispositifs médicaux exigent une lettre d’équivalence substantielle de la part de la FDA, indiquant que le dispositif destiné à la vente est aussi sûr et efficace que d’autres dispositifs similaires sur le marché. Ceci est obtenu en demandant une approbation préalable à la commercialisation (501k). Cosmereg peut aider votre entreprise dans le processus de candidature.

PMA (approbation préalable à la commercialisation)
Avant de pouvoir être vendus aux États-Unis, les appareils à risque élevé (classe III) doivent être approuvés avant leur commercialisation par la FDA. Ce processus peut s’avérer compliqué, car il nécessite la présentation de preuves cliniques de l’innocuité et de l’efficacité de l’appareil. Cosmereg propose un service complet d’applications d’approbation préalable à la mise sur le marché, garantissant que votre application satisfait à toutes les exigences de la FDA.

Exemption de dispositif humanitaire (HDE)
Pour les dispositifs destinés à être utilisés dans le traitement ou la gestion de patients atteints d’affections rares, il peut être difficile de satisfaire aux exigences en matière d’approbation préalable à la mise sur le marché, car les preuves cliniques sont limitées. Dans de tels cas, une exemption de dispositif humanitaire (HDE) peut être accordée. Cosmereg peut aider votre entreprise à postuler pour HDE.

Exemption d'appareil expérimental (IDE)
Afin de satisfaire aux exigences en matière d’approbation préalable à la mise sur le marché, des essais cliniques de dispositifs médicaux doivent être entrepris. Une autorisation spéciale existe pour l’utilisation et la vente de dispositifs dans ce contexte, connue sous le nom de «dispense de dispositif expérimental» (IDE). Cosmereg peut aider votre entreprise à demander cette exemption.

De novo submission
Les dispositifs entièrement nouveaux sont automatiquement classés dans la catégorie des dispositifs de classe III, car il n’est pas possible de procéder à une évaluation de l’équivalence avec d’autres dispositifs. Si votre appareil présente un risque faible, vous pouvez le démontrer à la FDA par le biais d’une application «De Novo» (513 [g]). Cosmereg peut aider votre entreprise tout au long de ce processus pour que votre appareil soit correctement classé le plus rapidement possible.
Besoin d’aide pour choisir le service qui vous convient le mieux ?
Contactez nous aujourd’hui pour une consultation gratuite
FAQ
Les matériels médicaux peuvent être définis comme étant de classe I, de classe II ou de classe III, selon le niveau de risque qu’ils représentent. Les seuls dispositifs qui doivent être approuvés par la FDA sont les dispositifs de classe III – la catégorie de risque la plus élevée. Pour qu’un dispositif de classe III soit approuvé par la FDA, le fabricant doit fournir la preuve de son efficacité et de sa sécurité.
Un agrément FDA n’est pas requis pour les dispositifs de classe I et II. Tous les fabricants d’instruments qui ne sont pas exclus de la Loi sur le FD&C doivent plutôt soumettre un avis de pré-commercialisation (510(k)) de la FDA à leur place. Le but de cette notification est de prouver à la FDA que cet appareil est au moins aussi sûr et efficace qu’un appareil qui est déjà sur le marché. Si la FDA trouve que cet appareil est substantiellement équivalent à d’autres appareils qui sont déjà sur le marché, il peut être commercialisé aux États-Unis. Ce n’est pas la même chose que l’approbation requise pour les instruments de classe III.
Les fabricants d’appareils doivent s’enregistrer auprès de la FDA et enregistrer leurs appareils.
Les fabricants d’appareils doivent s’enregistrer auprès de la FDA et lister leurs appareils. Cependant, ni l’enregistrement ni l’inscription de l’appareil n’indiquent l’approbation du fabricant ou du produit par la FDA.