Dispositivos médicos para los Estados Unidos
El término ‘Dispositivo médico’ se refiere a una enorme gama de productos, desde ropa de protección para profesionales de la salud, software, herramientas quirúrgicas y más. En los Estados Unidos, los dispositivos médicos están regulados por la Administración de Alimentos y Medicamentos (FDA). Ciertos dispositivos médicos requieren la aprobación de la FDA para su venta.
- Revisión precisa de la etiqueta
- Entrega rápida
- 10+ años de experiencia
Servicios de dispositivos médicos para los Estados Unidos

Servicio de Agente
Cualquier empresa extranjera que desee ingresar al mercado de los Estados Unidos, para ciertas categorías de productos, requiere la designación de un agente.
Registro de establecimiento de dispositivos médicos y listado de dispositivos
Los fabricantes de dispositivos médicos de cualquier clase deben registrarse en la FDA. Los fabricantes extranjeros también deben designar a un agente de los Estados Unidos para que actúe como intermediario entre el fabricante y la FDA. Cosmereg puede apoyar su negocio en el registro de establecimientos. También ofrecemos un servicio completo de agente de EE. UU. para nuestros clientes extranjeros.

Notificación de pre-mercado 510 (k)
Muchos dispositivos médicos requieren una carta de equivalencia sustancial de la FDA que indique que el dispositivo destinado a la venta es tan seguro y eficaz como otros dispositivos similares en el mercado. Esto se obtiene solicitando la aprobación previa a la comercialización (501k). Cosmereg puede ayudar a su empresa en el proceso de solicitud.

Aprovacion de pre-mercado PMA
Los dispositivos de alto riesgo (Clase III) requieren la aprobación previa a la comercialización por parte de la FDA antes de que puedan venderse en los EE. UU. Esto puede ser un proceso complicado, ya que requiere la presentación de pruebas clínicas de la seguridad y la eficacia del dispositivo. Cosmereg ofrece un servicio completo de solicitud de aprobación previa a la comercialización, asegurando que su aplicación cumpla con todos los requisitos de la FDA.

Exención de dispositivos humanitarios (HDE)
Para los dispositivos destinados al uso en el tratamiento o manejo de pacientes con enfermedades raras, puede ser difícil cumplir con los requisitos para la aprobación previa a la comercialización, ya que existe evidencia clínica limitada. En casos como estos, se puede otorgar la Exención de Dispositivos Humanitarios (HDE). Cosmereg puede ayudar a su empresa a solicitar HDE.

Exención de dispositivos de investigación (IDE)
Para cumplir con los requisitos para la aprobación previa a la comercialización, se deben realizar ensayos clínicos de dispositivos médicos. Existe un permiso especial para el uso y la venta de dispositivos en este contexto, conocido como «Exención de Dispositivo de Investigación» (IDE). Cosmereg puede ayudar a su empresa a solicitar esta exención.
Submision de novo
Los dispositivos totalmente nuevos se clasifican automáticamente como dispositivos de Clase III, ya que no es posible completar una evaluación de equivalencia con otros dispositivos. Si su dispositivo representa un riesgo bajo, puede demostrarlo a la FDA a través de una aplicación «De Novo» (513 [g]). Cosmereg puede ayudar a su empresa a través de este proceso para garantizar que su dispositivo se clasifique de la manera más rápida posible.
¿Tiene dudas sobre qué servicio es el adecuado?
Póngase en contacto con nosotros hoy para una consulta gratuita
Preguntas más frecuentes
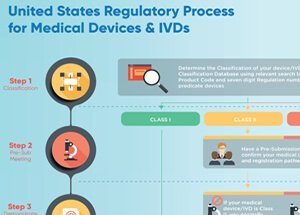
Los productos sanitarios pueden definirse como de clase I, clase II o clase III, en función del nivel de riesgo que representan. Los únicos dispositivos que requieren la aprobación de la FDA son los dispositivos de Clase III, la categoría de mayor riesgo. Para que un dispositivo de Clase III sea aprobado por la FDA, el fabricante debe proporcionar evidencia de su seguridad y efectividad.
La aprobación de la FDA no es necesaria para los dispositivos de Clase I y Clase II. Todos los fabricantes de dispositivos que no están exentos, en virtud de la Ley FD&C, deben presentar una notificación previa a la comercialización (510(k)) a la FDA en su lugar. El propósito de esta notificación es proporcionar evidencia a la FDA de que este dispositivo es al menos tan seguro y efectivo como un dispositivo que ya está en el mercado. Si la FDA determina que el dispositivo es sustancialmente equivalente a otros dispositivos que ya están en el mercado, puede ser comercializado en los Estados Unidos. No se trata de la misma homologación exigida para los dispositivos de Clase III.
Los fabricantes de dispositivos deben registrarse en la FDA y hacer un listado de sus dispositivos . Sin embargo, ni el registro ni el listado del dispositivo indica la aprobación de la FDA del fabricante o del producto.