医用-设备-美国食品及药物管理局
“医疗器械”一词指的是一系列产品,从医疗专业人员的防护服到软件,再到外科工具等等。在美国,医疗器械由食品药品管理局(FDA)监管,某些医疗器械的销售需要FDA的批准。
- 准确的标签审查
- 快速周转
- 10 年经验
美国医疗设备服务

医疗器械设立登记和器械清单
任何类别的医疗器械制造商必须向FDA注册。外国制造商还必须指定一个美国代理商作为制造商和FDA之间的中间人。Cosmereg可以支持您的企业注册机构。我们还为我们的外国客户提供全套的美国代理服务。

上市前通知510(K)
许多医疗器械都要求FDA提供实质性等效的信函,说明拟销售的器械与市场上其他类似器械一样安全有效,这是通过申请上市前批准(501K)获得的。Cosmereg可以在应用程序流程中支持您的业务。

PMA(上市前批准)
高风险(III类)设备在美国销售前需要获得FDA的上市前批准。这可能是一个复杂的过程,因为它需要提交设备安全性和有效性的临床证据。Cosmereg提供完整的上市前批准申请服务,确保您的申请符合FDA的所有要求。

人道主义设备豁免
对于用于治疗或管理罕见患者的装置,由于临床证据有限,很难满足上市前批准的要求。在这种情况下,人道主义设备豁免(HDE)可以被批准。Cosmereg可以支持您申请HDE。

临床器械豁免(IDE)
为了满足上市前审批的要求,必须对医疗器械进行临床试验。在这种情况下,存在使用和销售设备的特殊许可,称为“试验设备豁免”(IDE)。Cosmereg可以支持您的业务申请此豁免。
从头提交
全新设备自动归类为 III 类设备,因为无法完成与其他设备的等效性评估。如果您的设备代表低风险,您可以通过“从头开始”申请(513[g])向FDA证明这一点。Cosmereg可以支持您的公司完成这一过程,以确保您的设备是适当的分类尽可能快。
不知道该选择什么?
今天就联系我们,我们会咨询你
常问问题
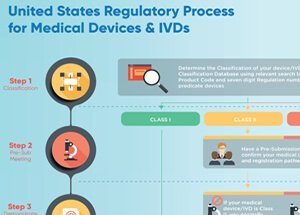
根据医疗器械所代表的风险水平,医疗器械可定义为I类、II类或III类。唯一需要FDA批准的设备是III类设备——最高风险类别。为了获得FDA批准的III类设备,制造商必须提供其安全性和有效性的证据。
I 级和 II 级设备无需FDA批准。根据《联邦食品、药品和化妆品法案》,所有非豁免设备制造商必须向食品和药品管理局提交上市前通知(510(k))。本通知的目的是向食品和药品管理局提供证据,证明该设备至少与已经上市的设备一样安全有效。与III类设备所需的认证不同,如果美国食品药品监督管理局发现该设备实质上等同于已经上市的其他设备,它可以在美国销售。
设备制造商必须在FDA注册并列出其设备。然而无论是注册还是列出该设备,都不表示FDA批准制造商或产品。