医療機器-FDA
「医療機器」という用語は、医療従事者のための防護服からソフトウェア、手術道具などに至るまで非常に幅広い製品を指します。米国では医療機器は食品医薬品局(FDA)によって規制されています。特定の医療機器の販売にはFDAの承認が必要です。
- 正確なラベルレビュー
- 迅速なターンアラウンド
- 10+年の経験
アメリカ市場向け医療機器販売支援サービス
医療機器施設登録および機器のリスト
分類に関係なく全ての医療機器の製造業者はFDAに登録しなければなりません。外国の製造業者はまたFDAとの間の仲介役として機能する米国のエージェントを任命する必要があります。Cosmeregは施設登録から御社の事業を支援することができます。また外国企業向けに包括的米国エージェントサービスも提供しています。

市販前届出(Premarket Notification 510(k))
多くの医療機器にはFDAによる「販売の意図される機器が市場の他の同様の機器と同等の安全性と効果を持つ」旨を記した“本質的な同等性”を示すレターが必要となります。これは、市販前届出を申請することによって取得できます。Cosmeregはこの申請プロセスのサポートを提供しています。

市販前承認
高リスク(クラスIII)に分類される機器を米国で販売する際には、事前にFDAによる市販前承認(PREMARKET APPROVAL)が必要となります。機器の安全性と有効性の臨床的証拠の提出が必要となるため、これは複雑なプロセスとなることがあります。御社の申請内容がすべてのFDA要件を満たすことができるよう、Cosmeregは包括的な市販前承認申請サービスを提供しています。

人道機器適用免除(HDE)
まれな状態の患者の治療または体調管理を目的とした機器では臨床的証拠が限られているため、市販前承認の要件を満たすことが困難になる場合があります。このような場合には、人道機器適用免除(HDE)が認められる可能性があります。Cosmeregは人道機器適用免除申請のサポートを提供しています。

治験医療機器適用免除(IDE)
市販前承認の要件を満たすためには、医療機器の臨床試験を実施する必要があります。このような状況下での機器の使用および販売に関しては、特別な許可が設けられています。それは「治験医療機器適用免除(Investigational Device Exemption)」です。Cosmeregはこの免除を申請するにあたり必要なサポートを提供しています。

デノボ(De Novo)
まったく新しい機器は、他の既存の機器と比較評価することが不可能であるため、自動的にクラスIIIに分類されます。実際に該当する機器のリスクが低い場合には デノボ(De Novo)申請(513 [g])を通しFDAにこれを証明できます。Cosmeregは、この申請プロセスの迅速かつ円滑な遂行を支援しています。
どのサービスが適しているかお悩みですか?
無料相談実施中! お気軽にお問い合わせ下さい
よくある質問
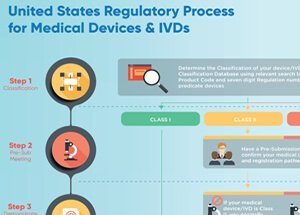
根据医疗器械所代表的风险水平,医疗器械可定义为I类、II类或III类。唯一需要FDA批准的设备是III类设备——最高风险类别。为了获得FDA批准的III类设备,制造商必须提供其安全性和有效性的证据。
I 级和 II 级设备无需FDA批准。根据《联邦食品、药品和化妆品法案》,所有非豁免设备制造商必须向食品和药品管理局提交上市前通知(510(k))。本通知的目的是向食品和药品管理局提供证据,证明该设备至少与已经上市的设备一样安全有效。与III类设备所需的认证不同,如果美国食品药品监督管理局发现该设备实质上等同于已经上市的其他设备,它可以在美国销售。
设备制造商必须在FDA注册并列出其设备。然而无论是注册还是列出该设备,都不表示FDA批准制造商或产品。