미국 FDA PPE, KN95, 수술용 및 비수술용 보호 얼굴 마스크 요건

외국 제조업체가 COVID-19 긴급 승인을 신청하기 위한 FDA EUA(Emergency Use Authorization) 가이드라인
- 1. 비수술용 얼굴 마스크(EUA 불필요) – 1단계st step
- 수입업체로 등록하고 제조업체를 FDA에 의료기기 제조 시설로 등록해야 합니다. 그리고 판매하려는 의료기기 제품을 리스팅 해야 합니다(FDA의 수수료는 회사마다 $5,236입니다. 각 업체는 매년 10월 1일에서 12월 31일 사이에 수수료를 지불하고 재등록해야 합니다).
- “보호 얼굴 마스크(Protective Face Mask)” 또는 이와 비슷하게 언급하도록 라벨을 수정해야 합니다.
- FDA가 요구하는 문구/경고문을 추가해야 합니다.
- 등록 및 리스팅이 완료되고, 라벨이 업데이트되면 수출할 수 있습니다.
- 수술용 얼굴 마스크(EUA) – 2단계
- EUA를 신청하고 라벨을 수정하여 “수술용 마스크” 또는 “N95 마스크”라고 언급해야 합니다.
다음은 EUA를 위한 요구 사항 목록입니다. 제조업체는 아래 표의 표준을 충족한다는 증거를 보유할 수 있습니다.
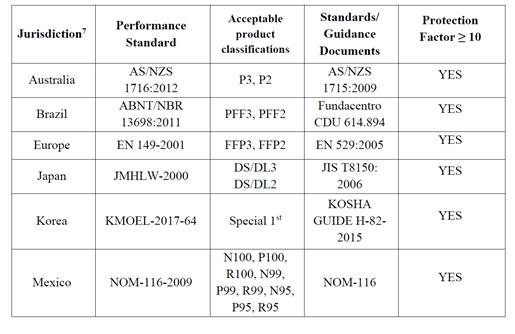
이러한 설계 및 테스트 표준에 관한 증거가 없는 경우 다음을 통해 승인 또는 인증을 받을 수 있습니다:
- 유럽 CE 마크
- 호주 치료용품 등록부(Australian Register of Therapeutic Goods: ARTG)의 증명서
- 헬스 캐나다(Health Canada) 라이선스
- 일본 제약 및 의료기기(Japan Pharmaceuticals and Medical Device: PMDA)/후생노동성(Ministry of Health Labour and Welfare: MHLW)
중국 제조업체면 NMPA의 인증서가 필요하며 EUA를 신청하고 라벨을 수정하여 “수술 마스크” 또는 “N95 마스크”라고 표시할 수 있습니다..
미국에서 PPE를 판매하려고 하는데 절차 및 규정을 잘 모르시는 경우 저희 FDA 규제 컨설턴트에게 문의하거나 070-4732-6728로 문의하시기 바랍니다.

Pasquale Carvelli is a Regulatory Strategy & International Compliance Advisor for Cosmereg, an international regulatory affairs company supporting manufacturers, distributors, and brand owners navigating complex compliance frameworks across multiple jurisdictions.
Through a multidisciplinary network of certified safety assessors and regulatory experts, he oversees strategic compliance pathways for cosmetic, food, and supplement products entering regulated markets.


