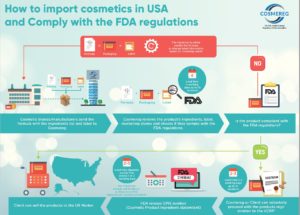
US FDA-Kosmetik bestimmungen und Anforderungen an die Etikettierung von Kosmetika
Die US-amerikanische FDA reguliert alle kosmetischen Produkte, die in den USA verkauft und verwendet werden sollen. Darüber hinaus hat der Bundesstaat Kalifornien seine eigenen Anforderungen, die über die übrigen Vorschriften der Vereinigten Staaten hinausgehen.
- Genaue Überprüfung des Etiketts
- Schneller Turnaround
- 10 Jahre Erfahrung
U.S. FDA-Dienstleistungen im Bereich Kosmetikregulierung
Cosmereg unterstützt sowohl in den Vereinigten Staaten ansässige als auch nicht in den USA ansässige Unternehmen mit FDA-Registrierung, die Kosmetikprodukte in den Vereinigten Staaten und im Bundesstaat Kalifornien verkaufen möchten.

FDA-Kosmetiketikettierung und Anforderungen an Inhaltsstoffe
Die FDA hat strenge Gesetze sowohl hinsichtlich der Inhaltsstoffe als auch der Kennzeichnung von Kosmetikprodukten. Einige Kosmetika werden sogar als Arzneimittel eingestuft, was die Anforderungen noch strenger und schwieriger zu erfüllen macht. Cosmereg kann Sie bei der FDA-Kosmetiketikettierung und den Anforderungen an die Einhaltung der Inhaltsstoffe unterstützen, indem wir Ihre Etikettierung mit dem Kodex der Bundesvorschriften, dem Bundesregister, dem VCRP-Lexikon für kosmetische Inhaltsstoffe, dem FDA-Etikettierungshandbuch und mehr abgleichen.

CSCA (Kalifornisches Gesetz für Sicherheitskosmetika) - Kalifornische Proposition 65)
Kalifornien veröffentlichte seinen Gesetz zur Sicherheit von Kosmetika (Safe Cosmetic Act) und war der erste Staat, der ein Gesetz zur Sicherheit und zur Berichterstattung über kosmetische Inhaltsstoffe verabschiedete. Das Programm zielt darauf ab, die Verbraucher zu schützen und die sichere Herstellung von Kosmetikprodukten zu fördern.
Es verpflichtet Hersteller, Verpacker oder Vertreiber mit einem Jahresumsatz von mindestens 1 Million Dollar, alle Kosmetikprodukte zu identifizieren, die Inhaltsstoffe enthalten, von denen bekannt ist, dass sie potentiell schädlich oder schädlich für Verbraucher sind – z.B. Inhaltsstoffe, die Krebs, Geburtsfehler usw. verursachen könnten. Sie müssen auch die Konzentration der Inhaltsstoffe im Produkt melden und den Bericht im Falle von Änderungen kontinuierlich aktualisieren. Gefährliche und potentiell gefährliche Inhaltsstoffe werden innerhalb einer Liste chemischer Inhaltsstoffe identifiziert, einschließlich Chemikalien, die unter der kalifornischen Proposition 65 sowie von der U.S. Umweltschutzbehörde (EPA), dem Zentrum zur Bewertung von Risiken für die menschliche Fortpflanzung (CERHR) und der Internationalen Agentur für Krebsforschung (IARC) aufgeführt sind.

FDA-Kosmetischer Farbzusatz
In den USA unterliegen alle Farbadditive – einschließlich Farbstoffe, Pigmente oder andere Substanzen, die einem Kosmetikprodukt Farbe verleihen – der Regulierung durch die US-FDA. Cosmereg bietet Unterstützung bei der Einhaltung der Standards und bei der Beantragung der Zertifizierung von kosmetischen Farbadditiven und Farbchargen bei der FDA. Unser Team kann Berichte über die spezifischen Anforderungen erstellen, Sie beim Protokoll beraten und Ihnen bei der Beantragung der Zertifizierung helfen, damit der Prozess schneller und reibungsloser verläuft.

FDA OTC-Zulassung
Es gibt einige Produkte, die sowohl den gesetzlichen Definitionen für Kosmetika als auch für Arzneimittel entsprechen. Dies kann passieren, wenn ein Produkt zwei rechtmäßige Verwendungszwecke hat. Eine der primären Kosmetik-/Drogenkombinationen sind Produkte mit Anti-Akne-, Zahnpasta- & Anti-Karies-, Anti-Schuppen-, Haarwuchs-/Haarausfall-, Hautbleich-, Hand-Sanitzer- und Sonnenschutzansprüchen. Die Inhaltsstoffe dieser Produkte werden von der FDA sowohl als Kosmetika als auch als rezeptfreie Arzneimittel (OTC) reguliert. In diesen speziellen Fällen müssen die Produkte den Kosmetikvorschriften der FDA und den Arzneimittelvorschriften der FDA entsprechen. Hier unten die Schritte und Anforderungen zur Einhaltung:
- Überprüfung der Wirkstoffe, um zu überprüfen, ob sie der US-FDA-OTC-Monographie entsprechen
- Ernennen Sie einen US-Agenten und registrieren Sie die Drogeneinrichtung
- Fordern Sie den Labeler-Code an und erhalten Sie die NDC-Nummer
- Arzneimittelliste über elektronisches Portal nach Erhalt der NDC-Nummer
Das Produkt muss den cGMP-Standards entsprechen;
Erst nach elektronischer Registrierung kann das Produkt in die Vereinigten Staaten importiert werden:
Der gesamte Prozess kann 15 Arbeitstage dauern.
Cosmereg kann Sie bei der Einhaltung der FDA-Registrierung für Kosmetikhersteller unterstützen, den Etikettiercode und die Arzneimittelliste anfordern, unabhängig von der spezifischen Kategorie.

FDA VCRP-Kosmetik-Registrierung
Cosmereg kann Sie bei allen US-Kosmetikbestimmungen unterstützen und der Industrie bestätigen, dass Sie die FDA-Registrierungsanforderungen der Vereinigten Staaten erfüllen, einschließlich der Berichterstattung, die vom California Safe Cosmetics Program und dem FDA der VCRP der Vereinigten Staaten verlangt wird.
FDA-Unterstützung beim Gewahrsam
Kosmetikprodukte, die sich als nicht konform mit den FDA-Vorschriften erweisen, können von FDA Compliance Beauftragten am U.S. Eingangshafen zurückgehalten werden. Wenn Sie sofortige Hilfe bei der FDA-Haft benötigen, können wir mit Ihnen zusammenarbeiten, um das Problem zu lösen, so dass das Produkt am Eingangshafen vorbei in die Hände der vorgesehenen Empfänger gelangt. Wenn Sie ein Produkt auf eine Grüne Liste setzen oder von einer Roten Liste streichen lassen möchten, können wir Ihnen ebenfalls helfen.
Sie wissen nicht, was Sie wählen sollen?
Kontaktieren Sie uns noch heute für eine kostenlose Beratung
FAQ
Schönheitsprodukte (Kosmetika) müssen vor der Vermarktung nicht von der FDA genehmigt werden. Einige ihrer Inhaltsstoffe, wie z.B. Farbadditive, können jedoch eine unabhängige Zulassung erfordern. Unternehmen, die Kosmetika herstellen, müssen sich nicht bei der FDA registrieren lassen. Alle Produkte müssen jedoch sicher sein, wenn sie wie angegeben verwendet werden.
Manchmal können Schönheitsprodukte, die behaupten, Vorteile zu haben, die über die Verbesserung oder Veränderung des Aussehens hinausgehen, als Arzneimittel eingestuft werden. Sonnenschutzmittel sind ein Beispiel dafür. In Fällen wie diesem benötigen diese Produkte eine FDA-Zulassung.
Die FDA klassifiziert Produkte aufgrund ihres Verwendungszwecks als Kosmetika. Der Zweck eines Produktes kann auf verschiedene Weise bewertet werden – durch die im Marketing beschriebenen Wirkungen, was die Kunden von ihm erwarten, und sogar durch bestimmte Inhaltsstoffe. Die FDA definiert Kosmetika als „Artikel, die dazu bestimmt sind, eingerieben, gegossen, besprüht oder aufgesprüht, in den menschlichen Körper eingeführt oder anderweitig auf den menschlichen Körper aufgetragen zu werden… zur Reinigung, Verschönerung, Förderung der Attraktivität oder zur Veränderung des Aussehens“. Einige Beispiele für Produkte, die als Kosmetika definiert werden, sind
Lippenstifte, Lidschatten, Grundierungen und andere Make-up-Produkte.
Feuchtigkeitscremes für Gesicht und Körper.
Haarfärbemittel und Dauerwellenlösungen.
Körperdüfte und Parfüms.
Nagellacke, Cremes für die Nagelhaut usw.
Arzneimittel sind im Vergleich dazu Produkte, die definiert sind als „Artikel, die zur Verwendung bei der Diagnose, Heilung, Linderung, Behandlung oder Vorbeugung von Krankheiten bestimmt sind… und Artikel (außer Lebensmitteln), die dazu bestimmt sind, die Struktur oder irgendeine Funktion des Körpers von Menschen oder anderen Tieren zu beeinflussen“. Manchmal erfüllt ein Produkt die Kriterien, um sowohl als Arzneimittel als auch als Kosmetikum eingestuft zu werden, basierend auf seiner beabsichtigten Verwendung und Wirkung.
Die FDA erkennt „medizinische Geräte“ und „Nahrungsergänzungsmittel“ als getrennte Kategorien an, während andere Produkte, wie z.B. Seifen, von der Kommission für die Sicherheit von Konsumgütern reguliert werden.
Die FDA ermutigt sowohl nationale als auch internationale Kosmetikfirmen, sich bei ihrem Voluntary Cosmetic Registration Program (VCRP) zu registrieren. Die Registrierung bei diesem Programm ist vollkommen freiwillig und es ist keine Registrierungsnummer erforderlich, um Kosmetika in die Vereinigten Staaten zu importieren. Das VCRP akzeptiert nur Cosmetic Product Ingredient Statements (CPIS) für Produkte, die bereits in den USA vertrieben werden.
Wenn Ihre Produkte jedoch als Arzneimittel oder sowohl Kosmetika als auch Medikamente klassifiziert sind, müssen sie von der FDA genehmigt werden. Gleichermaßen müssen Unternehmen, die Inhaltsstoffe für ihre Kosmetika importieren, die auch als Lebensmittel eingestuft werden können, die Registrierungsanforderungen des Bioterrorismusgesetzes von 2002 erfüllen.
Die FDA gibt nicht an, welche Tests für jedes Schönheitsprodukt oder jeden Inhaltsstoff erforderlich sind. Als Hersteller liegt es jedoch in Ihrer Verantwortung, sicherzustellen, dass Ihre Produkte sicher sind, wenn sie wie in den Anweisungen angegeben verwendet werden.
Einige Hersteller, insbesondere diejenigen, die neu auf dem Markt sind, können glauben, dass ein Produkt sicher ist, weil sie es selbst ohne nachteilige Auswirkungen verwendet haben, oder weil die Inhaltsstoffe alle „natürlich“ sind. Dies ist nicht korrekt.
OTC-Arzneimittel sind solche, die ohne ärztliche Verschreibung verkauft werden können. In diesen Fällen reguliert die FDA nicht die einzelnen Produkte, sondern die Rezepturen und die Kennzeichnung verschiedener Arzneimittelklassen. Die FDA entwickelt „Monographien“ mit Richtlinien für deren Herstellung, Vertrieb und Anwendung. Sobald die Monographie entwickelt ist, können Unternehmen diese Medikamente ohne Vorab-Zulassung durch die FDA produzieren und verkaufen, solange sie gemäß den Richtlinien hergestellt werden. Monographien werden verwendet, um die Sicherheit, Wirksamkeit und erforderliche Kennzeichnung aller OTC-Produkte festzulegen.
Eine „Monographie“ wird verwendet, um die sichere und angemessene Herstellung und Verwendung von OTC-Arzneimitteln zu definieren. Sie umfasst Inhaltsstoffe, Dosierungen, Formulierung, Anwendungsgebiete und die Art und Weise, wie das Produkt zu etikettieren ist. Unternehmen können diese Arzneimittel ohne eine spezielle Produktlizenz herstellen und verkaufen, solange sie mit den in der Monografie festgelegten Bestimmungen übereinstimmen. Monographien werden im Code of Federal Regulations(CFR) der Regierung veröffentlicht. Die Aufgabe der FDA ist es, sicherzustellen, dass die Verpflichtungen des Federal Food, Drug and Cosmetic Act erfüllt werden.
Wir bieten andere Dienstleistungen für die Vereinigten Staaten an