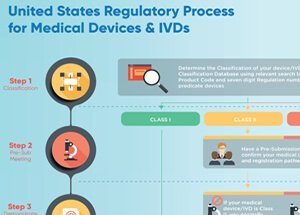
Registrierungs-/Genehmigungsdienste für Medizinprodukte für die FDA der Vereinigten Staaten
Der Begriff „Medizinprodukt“ bezieht sich auf eine enorme Auswahl an Produkten, von Schutzkleidung für medizinisches Fachpersonal über Software bis hin zu chirurgischen Instrumenten und mehr. In den USA werden Medizinprodukte von der amerikanischen Lebensmittel- und Arzneimittelbehörde FDA reguliert. Bestimmte medizinische Geräte benötigen für ihren Verkauf eine FDA-Zulassung.
- Genaue Überprüfung
- Schnelle Einreichung
- 5 Jahre Erfahrung
U.S. FDA-Vorschriften für Medizinprodukte

Registrierung und Auflistung von Einrichtungen für Medizinprodukte
Hersteller von Medizinprodukten jeder Klasse müssen sich bei der FDA registrieren lassen. Ausländische Hersteller müssen außerdem einen US-Vertreter ernennen, der als Vermittler zwischen dem Hersteller und der FDA fungiert. Cosmereg kann Ihr Unternehmen bei der Registrierung von Einrichtungen unterstützen. Wir bieten auch einen vollständigen U.S.-Agentenservice für unsere ausländischen Kunden an

Anmeldung vor dem Inverkehrbringen 510 (k)
Für viele Medizinprodukte ist ein Schreiben der FDA über die substanzielle Äquivalenz erforderlich, aus dem hervorgeht, dass das zum Verkauf vorgesehene Produkt genauso sicher und wirksam ist wie andere ähnliche Produkte auf dem Markt. Dies wird durch die Beantragung einer Zulassung vor dem Inverkehrbringen erreicht (501k). Cosmereg kann Ihr Unternehmen im Antragsverfahren unterstützen.

PMA (Zulassung vor der Markteinführung)
Hochrisikoprodukte (Klasse III) erfordern eine Zulassung durch die FDA vor dem Inverkehrbringen, bevor sie in den USA verkauft werden können. Dies kann ein komplizierter Prozess sein, da er die Vorlage klinischer Beweise für die Sicherheit und Wirksamkeit des Produkts erfordert. Cosmereg bietet einen vollständigen Antragsservice für die Zulassung vor dem Inverkehrbringen an, um sicherzustellen, dass Ihr Antrag alle Anforderungen der FDA erfüllt.

Ausnahme für humanitäre Geräte (HDE)
Bei Produkten, die für die Behandlung oder das Management von Patienten mit seltenen Erkrankungen eingesetzt werden sollen, kann es schwierig sein, die Anforderungen für eine Zulassung vor dem Inverkehrbringen zu erfüllen, da nur begrenzte klinische Beweise vorliegen. In solchen Fällen kann eine Ausnahmegenehmigung für humanitäre Geräte erteilt werden. Cosmereg kann Ihr Unternehmen bei der Beantragung einer Ausnahmegenehmigung für Humanitäre Geräte unterstützen.

Ausnahmeregelung für Prüfpräparate (IDE)
Um die Anforderungen für die Zulassung vor dem Inverkehrbringen zu erfüllen, müssen klinische Versuche mit Medizinprodukten durchgeführt werden. Für die Verwendung und den Verkauf von Geräten in diesem Zusammenhang besteht eine Sondergenehmigung, die als „Investigational Device Exemption“ (IDE) bezeichnet wird. Cosmereg kann Ihr Unternehmen bei der Beantragung dieser Ausnahmegenehmigung unterstützen.
Erneute Einreichung
Völlig neue Produkte werden automatisch als Produkte der Klasse III kategorisiert, da es nicht möglich ist, eine Beurteilung der Äquivalenz mit anderen Produkten abzuschließen. Wenn Ihr Produkt ein geringes Risiko darstellt, können Sie dies der FDA durch einen „De Novo“-Antrag (513[g]) nachweisen. Cosmereg kann Ihr Unternehmen bei diesem Verfahren umfassend unterstützen, um sicherzustellen, dass Ihr Gerät so schnell wie möglich entsprechend klassifiziert wird.
Sie wissen nicht, was Sie wählen sollen?
Kontaktieren Sie uns noch heute für eine kostenlose Beratung
FAQ
Medizinprodukte können je nach dem Grad des Risikos, das sie darstellen, als Klasse I, Klasse II oder Klasse III definiert werden. Die einzigen Produkte, die einer Genehmigung durch die FDA bedürfen, sind Produkte der Klasse III – der höchsten Risikokategorie. Damit ein Gerät der Klasse III von der FDA zugelassen werden kann, muss der Hersteller den Nachweis seiner Sicherheit und Wirksamkeit erbringen.
Eine FDA-Zulassung ist für Produkte der Klasse I und Klasse II nicht erforderlich. Alle Hersteller von Produkten, die nach dem FD&C Gesetz nicht freigestellt sind, müssen stattdessen eine Premarket Notification (510(k)) bei der FDA einreichen. Der Zweck dieser Anmeldung ist es, der FDA den Nachweis zu erbringen, dass dieses Produkt mindestens so sicher und wirksam ist wie ein bereits auf dem Markt befindliches Produkt. Wenn die FDA feststellt, dass dieses Gerät im Wesentlichen gleichwertig mit anderen bereits auf dem Markt befindlichen Geräten ist, kann es in den USA vermarktet werden. Dies ist nicht dasselbe wie die Zulassung, die für Produkte der Klasse III erforderlich ist.
Gerätehersteller müssen sich bei der FDA registrieren lassen und ihre Geräte auflisten. Weder die Registrierung noch die Listung des Geräts bedeutet jedoch, dass der Hersteller oder das Produkt von der FDA zugelassen ist.
Wir bieten andere Dienstleistungen für die Vereinigten Staaten an