Dispositivos Médicos nos EUA
O termo “Dispositivo Médico” refere-se a uma enorme variedade de produtos: roupas de proteção para profissionais de saúde, softwares, ferramentas cirúrgicas e muito mais. Nos EUA, os dispositivos médicos são regulados pelo “Food and Drugs Administration” (FDA). Certos dispositivos médicos exigem a aprovação do FDA para viabilizar a sua venda.
- Revisão de etiqueta precisa
- Turnaround Rápido
- 5 anos de experiência
Serviços oferecidos para “Dispositivos Médicos”, Estados Unidos

Registo de estabelecimento de dispositivo médico e listagem de dispositivos
Fabricantes de dispositivos médicos de qualquer classe, devem se registrar no FDA. Os fabricantes estrangeiros também devem nomear um “US Agente”, ou “Agente Americano”, para agir como um intermediário entre o fabricante e o FDA. A Cosmereg pode apoiar o seu negócio no registro de estabelecimentos. Também oferecemos um serviço completo de agente americano para nossos clientes estrangeiros.

Notificação pré-comercialização (510k)
Muitos dispositivos médicos exigem uma carta de equivalência substancial da FDA, afirmando que o dispositivo destinado à venda é tão seguro e eficaz quanto outros dispositivos semelhantes no mercado. Isso pode ser obtido mediante solicitação de aprovação pré-comercialização (501k). A Cosmereg pode ajudar a sua empresa no processo de candidatura.

PMA (aprovação pré-comercialização)
Dispositivos de alto risco (Classe III) necessitam da “Aprovação pré-comercialização” (fornecida pelo FDA) antes de serem comercializados nos Estados Unidos. Este pode ser um processo complicado, pois requer a apresentação de evidências clínicas de segurança e eficácia do dispositivo. A Cosmereg oferece um serviço completo de solicitação de aprovação pré-comercialização, garantindo que sua candidatura atenda a todos os requisitos da FDA.

Isenção de Dispositivo Humanitário (HDE)
Para dispositivos destinados ao uso no tratamento de pacientes com condições raras, pode ser difícil atender aos requisitos de aprovação pré-comercialização, pois existem evidências clínicas limitadas. Em casos como esses, a Isenção de Dispositivo Humanitário (Humanitarian Device Exemption, HDE) pode ser concedida. A Cosmereg pode ajudar a sua empresa na solicitação de HDE.

Isenção de Dispositivo Investigacional (IDE)
Para atender aos requisitos de aprovação pré-comercialização, os ensaios clínicos de dispositivos médicos devem ser realizados. Existe uma permissão especial para o uso e a venda de dispositivos nesse contexto, conhecida como “Investigational Device Exemption” (IDE). A Cosmereg pode ajudar a sua empresa na solicitação e obtenção desta isenção.
"De Novo"
Dispositivos totalmente novos são categorizados automaticamente como dispositivos de Classe III, já que não é possível realizar uma avaliação de equivalência com outros dispositivos. Se o seu dispositivo representa um risco baixo, você pode demonstrar isso ao FDA através de uma aplicação “De Novo” (513 [g]). A Cosmereg pode ajudar a sua empresa neste processo, para garantir que o seu dispositivo seja devidamente classificado o mais rapidamente possível.
Não sabe o que escolher?
Contate-nos hoje para uma consulta gratuita
Perguntas frequentes
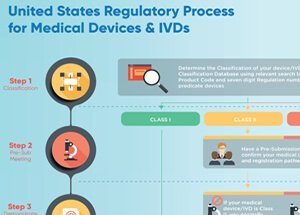
Os dispositivos médicos podem ser definidos como Classe I, Classe II ou Classe III, com base no nível de risco que representam. Os únicos dispositivos que exigem aprovação do FDA são os dispositivos Classe III – a categoria de maior risco. Para que um dispositivo Classe III seja aprovado pelo FDA, o fabricante deve fornecer evidências de sua segurança e eficácia.
A aprovação do FDA não é necessária para dispositivos Classe I e Classe II. Todos os fabricantes de dispositivos que não estejam isentos, (conforme Lei FD&C), devem enviar uma notificação de pré-comercialização (510k) para o FDA. O objetivo desta notificação é fornecer evidências para o FDA de que esse dispositivo é, pelo menos, tão seguro e eficaz quanto um dispositivo que já está no mercado. Se o FDA achar que este dispositivo é substancialmente equivalente a outros dispositivos que já estão no mercado, ele pode ser comercializado nos EUA. Atenção, isso não é o mesmo que a aprovação necessária para dispositivos Classe III.
Os fabricantes de dispositivos devem se registrar no FDA e listar seus produtos. No entanto, nem o registro, nem a listagem do dispositivo indicam a aprovação do fabricante ou do produto pelo FDA.
Oferecemos outros serviços para os Estados Unidos