Registrazione dispositivi medici FDA Stati Uniti
Il termine “Dispositivo Medico” si riferisce a una vasta gamma di prodotti, dall’abbigliamento protettivo per gli operatori sanitari, al software, agli strumenti chirurgici e altro ancora. Negli Stati Uniti, i dispositivi medici sono regolati dalla Food and Drugs Administration (FDA). Alcuni dispositivi medici richiedevano l’approvazione della FDA per la loro vendita.
- Revisione Etichettatura Accurata
- Servizio Rapido
- 10+ anni di Esperienza
Servizi FDA per Dispositivi Medici
Registrazione dello Stabilimento Produttivo e Notifica Del Dispostivo Medico
I produttori di dispositivi medici di qualsiasi classe devono registrarsi presso la FDA. I produttori stranieri devono anche nominare un agente degli Stati Uniti come intermediario tra il produttore e la FDA. Cosmereg può supportare la tua azienda nella registrazione degli stabilimenti. Offriamo inoltre un servizio completo per gli agenti degli Stati Uniti per i nostri clienti stranieri.
Notifica PreMarket 510 (K)
Molti dispositivi medici richiedono una lettera di sostanziale equivalenza da parte della FDA, affermando che il dispositivo destinato alla vendita è altrettanto sicuro ed efficace di altri dispositivi simili sul mercato. Ciò si ottiene applicando l’approvazione pre-commercializzazione (501k). Cosmereg può supportare la tua azienda nel processo di richiesta.
PMA (Approvazione PreMarket)
I dispositivi ad alto rischio (Classe III) richiedono l’approvazione da parte della FDA prima che possano essere venduti negli Stati Uniti. Questo può essere un processo complicato, poiché richiede la presentazione di prove cliniche sulla sicurezza e l’efficacia del dispositivo. Cosmereg offre un servizio completo di applicazione per l’approvazione pre-vendita, garantendo che l’applicazione soddisfi tutti i requisiti FDA.

Humanitarian Device Exemption (HDE)
Per i dispositivi destinati all’uso nel trattamento o nella gestione di pazienti con condizioni rare, può essere difficile soddisfare i requisiti per l’approvazione del mercato, in quanto esistono prove cliniche limitate. In casi come questi, è possibile concedere l’esenzione per dispositivi umanitari (HDE). Cosmereg può supportare la tua azienda nella richiesta di HDE.

Esenzione Di Dispositivo di Ricerca (IDE)
In order to meet the requirements for premarket approval, clinical trials of medical devices must be undertaken. A special permission exists for the use and sale of devices in this context, known as ‘Investigational Device Exemption’ (IDE). Cosmereg can support your business in applying for this exemption and 21 cfr 803.

Notifica DE NOVO
I dispositivi completamente nuovi vengono automaticamente classificati come dispositivi di Classe III, in quanto non è possibile completare una valutazione dell’equivalenza con altri dispositivi. Se il tuo dispositivo rappresenta un basso rischio, puoi dimostrarlo alla FDA attraverso un’applicazione ‘De Novo’ (513 [g]). Cosmereg può supportare la tua azienda in questo processo per garantire che il tuo dispositivo sia classificato nel modo più rapido possibile.
Hai dei dubbi sul Procedimento?
Contattaci per una consulenza gratuita
FAQ
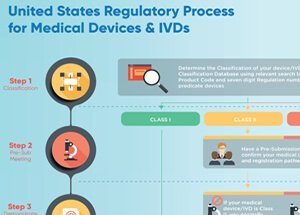
I dispositivi medici possono essere definiti come Classe I, Classe II o Classe III, in base al livello di rischio che rappresentano. Gli unici dispositivi che richiedono l’approvazione della FDA sono dispositivi di Classe III – la categoria di rischio più elevata. Affinché un dispositivo di Classe III sia approvato dalla FDA, il produttore deve fornire prove della sua sicurezza ed efficacia.
L’approvazione della FDA non è richiesta per i dispositivi di Classe I e Classe II. Tutti i produttori di dispositivi che non sono esentati, ai sensi della legge FD & C, devono invece inviare alla notifica di pre-vendita (510 (k)) alla FDA. Lo scopo di questa notifica è di fornire alla FDA evidenza che questo dispositivo è almeno altrettanto sicuro ed efficace di un dispositivo che è già sul mercato. Se la FDA rileva che questo dispositivo è equivalente ad altri dispositivi già presenti sul mercato, può essere commercializzato negli Stati Uniti. Questo non è lo stesso dell’omologazione richiesta per i dispositivi di Classe III.
I produttori di dispositivi devono registrarsi presso la FDA e elencare i propri dispositivi. Tuttavia, né la registrazione né l’elenco del dispositivo indicano l’approvazione FDA del produttore o del prodotto.